2025年7月3日,我校生命科学与健康工程学院、细胞调控与分子药物“111”引智基地、发酵工程教育部重点实验室唐景峰、周策凡团队在Nature子刊Nature Communications(IF=15.7)发表了题为“DRAM1 promotes the stability of lysosomal VAMP8 to enhance autolysosome formation and facilitates the extravasation”的科研成果。我校为论文第一署名单位,生命科学与健康工程学院张瑞副教授为第一作者,湖北工业大学唐景峰、周策凡为共同通讯作者。

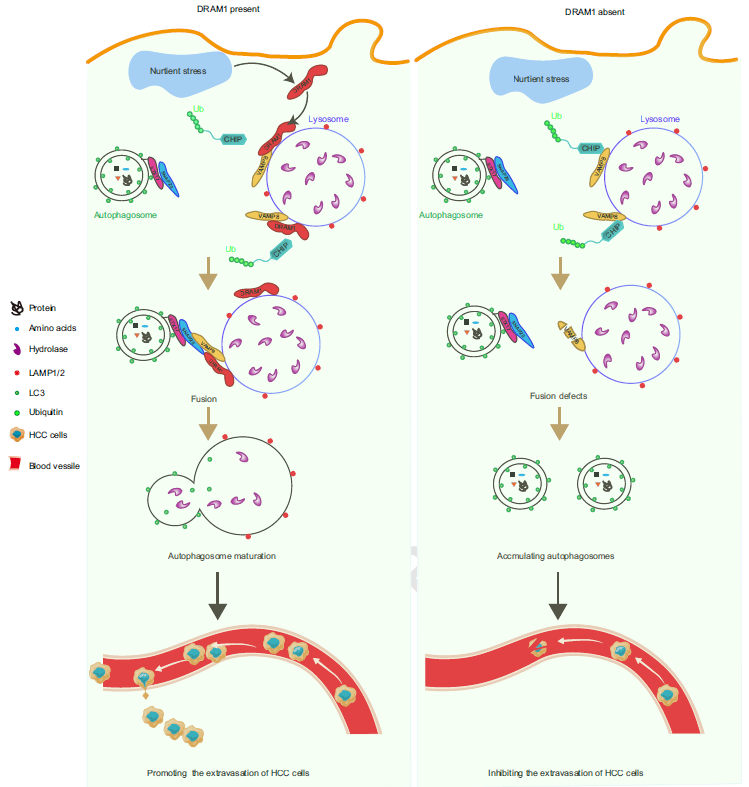
转移是导致肿瘤患者死亡的首要原因。肿瘤细胞从原发部位经血管扩散至远端器官,这一过程称为外渗(extravasation),即肿瘤细胞在血管中存活并穿出血管壁。成功转移的先决条件是循环肿瘤细胞(CTCs)能够在血管内存活。然而,进入循环系统的绝大多数肿瘤细胞会因营养应激、免疫清除及血流剪切力等因素在短期内被迅速清除。因此,开发靶向外渗过程的治疗策略,对抑制转移具有重大意义。近年研究发现,自噬可帮助循环肿瘤细胞在血液中存活。自噬体与溶酶体的融合是自噬过程的终末关键步骤,其分子机制依赖于多层级膜转运机器(如SNARE复合物介导的膜融合)和精密时空调控网络,但具体调控机制尚未完全阐明。本研究首次证实DRAM1通过调控自噬活动促进肝癌细胞血管外渗过程中发挥关键作用。该研究不仅阐明了DRAM1-VAMP8调控自噬溶酶体形成的新机制,更为抑制肝癌转移提供了潜在的治疗策略。
自噬是细胞分解代谢自身物质以供循环利用的过程,需要自噬体和溶酶体之间的有效融合才能有效发挥作用。在不同的刺激下,自噬体开始形成,随后与溶酶体融合以降解底物。VAMP8(囊泡相关膜蛋白8)是一种v-SNARE蛋白,属于SNARE蛋白家族成员,参与多种膜融合过程。它的分子结构包含一个SNARE基序功能结构域和一个跨膜结构域,使其能够锚定在生物膜上发挥作用。VAMP8主要定位于内体、囊泡、溶酶体膜等位置。在自噬功能方面,VAMP8在自噬体与溶酶体融合过程中起关键作用。它与STX17和SNAP29形成SNARE复合物,促进自噬体和溶酶体融合。这项研究中,该团队首次鉴定出VAMP8相互作用的关键融合调节蛋白-DNA损伤调节自噬调控因子1(DNA Damage-Regulated Autophagy Modulator 1)DRAM1。DRAM1是溶酶体跨膜蛋白,在自噬过程中发挥关键调控作用。它最初在2006年被鉴定为p53的下游靶基因,并通过促进自噬体-溶酶体融合来维持自噬流。DRAM1与VAMP8共同定位于溶酶体上,但两者的作用功能还是未知的。接着,研究团队发现DRAM1能够改变VAMP8的蛋白稳定性,从而促进自噬溶酶体的降解。随后,本团队利用溶酶体分离技术发现,DRAM1能够偏好性的促进溶酶体上VAMP8的蛋白稳定性。
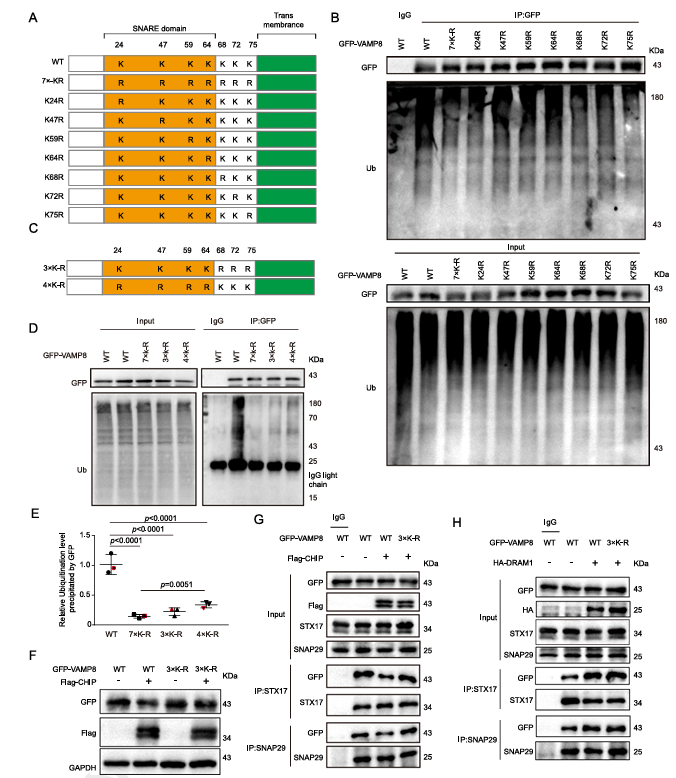
图1:DRAM1竞争性与CHIP与VAMP8结合并抑制其泛素化
随后,课题组利用质谱鉴定技术发现多个相关的E3泛素化连接酶与VAMP8相结合,并最终证实CHIP是VAMP8泛素化的关键E3连接酶。进一步的研究发现,DRAM1可竞争性的同CHIP与VAMP8的结合,主要抑制了VAMP8在Lys68、72和75位点的泛素化修饰,从而维持溶酶体VAMP8的蛋白稳定性。
最后,该团队分别利用小鼠尾静脉注射转移模型,发现了DRAM1能够促进肝癌细胞在靶器官,肺脏和肝脏上的转移,这表明DRAM1促进了肝癌细胞的血管外渗过程。接着,通过荧光素酶活体成像实验发现,DRAM1提高了肝癌细胞的肿瘤转移率。最后,利用斑马鱼血管模型和斑马鱼脑室血脑屏障模型也证实了DRAM1促进肝癌细胞的血管外渗过程,且该过程依赖于DRAM1所调控的自噬体降解功能。
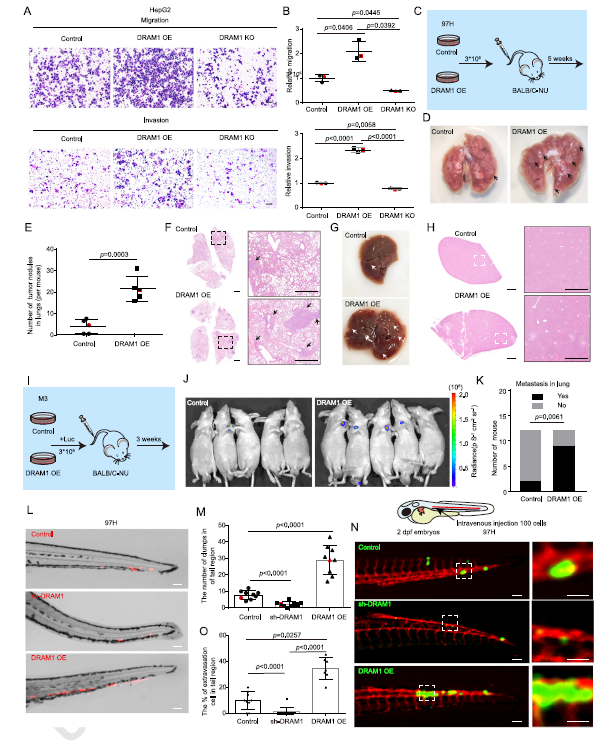
图2: DRAM1促进肝癌细胞的血管外渗
本研究首次证实DRAM1在肝癌转移和外渗过程中发挥关键作用。已有报道显示,外渗的肿瘤细胞在血液循环中的半衰期极短(2-10分钟),导致仅有极少部分外渗细胞能成功抵达远端部位。肿瘤细胞自噬活动增强有利于肿瘤细胞血管外渗和转移。与此一致的是,当自噬体形成受阻时,肝癌细胞的外渗能力显著受限。本项工作从机制上阐释了DRAM1通过促进自噬溶酶体形成来驱动血管外渗过程,本研究不仅探索基于自噬调控的肝癌治疗策略提供了新的研究方向,也同时提出DRAM1靶向治疗作为抑制肿瘤细胞血管外渗的临床转化。
本研究得到国家自然科学基金(82273970、32270768、82370715、32125011)、国家重点研发计划(2023YFC2507900)、湖北省自然科学基金(2024AFB765), 湖北省创新群体(2023AFA026)、湖北省战略人才计划(2024DJA037)、湖北省杰青项目(2025AFA085)以及武汉市曙光科技项(2023020201020376)的支持。2023届硕士研究生张鑫、和2021届硕士研究生白华为共同第一作者。本项研究成果的合作单位还有华中科技大学、伦敦国王学院和加拿大阿尔伯塔大学等单位。
责任编辑:陈凌
